Епідерміс — аванпост імунної системи

«Медицинская вселенная». Cпецвыпуск по проблемам ВИЧ / СПИДа. Том 3. (2003)
Эпидермис — аванпост иммунной системы.
Клеточные и гуморальные механизмы защиты.
Главная задача иммунной системы состоит в том, чтобы предохранить хозяина, устраняя или нейтрализуя инородные молекулы при одновременном сбережении или признании молекул, которые принадлежат хозяину. Эпидермис — неотъемлемая часть иммунной системы, первый заслон на пути проникновения микроорганизмов, излучений, механических повреждений. Он первый встречает и разрушает антигены, его клетки инициируют и стабилизируют иммунный статус организма.
Защита от проникновения микроорганизмов
Сохранность и целостность рогового слоя (РС) являются необходимыми условиями предотвращения проникновения микроорганизмов через кожу [1]. РС состоит из клеточных и молекулярных компонентов. Постоянная десквамация корнеоцитов РС способствует удалению патогенных микроорганизмов. Другие факторы обеспечивают механическую прочность РС, кислотность — водородный показатель поверхности кожи обычно колеблется в пределах от 4 до 6.5 [2], и устойчивость к присутствию резидентной непатогенной флоры (Propionibacterium acne, Staphylococcus epidermidis, Pityrosporum ovale). Если травма или другие факторы нарушают непрерывность и механическую целостность кожного барьера — эти микроорганизмы могут становиться патогенными.
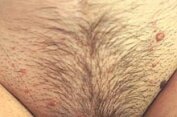
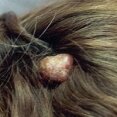
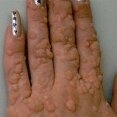
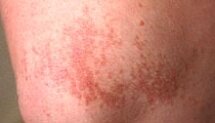
Молекулярные компоненты — липиды — постоянно присутствуют на поверхности кожи, формируя супракутанный барьер. Они возникают за счет секреции сальных желез и клеток эпидермиса, играют важную роль в антимикробной защите. Свободные жирные кислоты образуются в результате воздействия бактериальных гидролитических ферментов на триглицериды кожного жира. Экспериментальные данные свидетельствуют о том, что и эндогенные липиды кожи могут влиять на антимикробное сопротивление кожи. В дополнение к свободным жирным кислотам, эпидермис производит полярные липиды и гликосфинголипиды, которые обладают поверхностной активностью, и, аналогично сурфактантам легкого, осуществляют антибактериальную деятельность "in vitro" и "in vivo" [3]. При нарушении целостности кожного покрова и появления входных ворот для инфицирования развиваются многие кожные заболевания. Среди них — сифилис, герпес, контагиозный моллюск (рис. 1), пиогенные гранулемы (рис. 2), бородавки (рис. 3, 4) и др.
|
|
|
|
 |
|
Контагиозный моллюск. |
Гигантская пиогенная гранулема на волосистой части головы. Рост опухоли спровоцирован микротравмой. |
Множественные вирусные бородавки кистей рук. |
Множественные плоские бородавки в области коленного сустава. |
Защита против механических повреждений
Хотя толщина РС — всего 15-20 мкм, прочность его достаточно высока. Она зависит от наличия высокопрочной ороговевшей оболочки, структурных белков (кератиновые волокна, филаггрин) корнеоцитов, десмосом, которые связывают смежные клетки. Влагоудерживающая (гидрофильная) способность РС зависит от содержания белков и фосфолипидов. Она является важным компонентом поддержания упругости кожи [4]. Способность влагоудержания зависит также от свободных аминокислот, образующихся путем гидролиза филаггрина [5]. Фосфолипиды особенно важны для влагоудержания, поскольку они имеют гидрофильные группы и расположены в межклеточных пространствах РС. Церамиды с относительно короткими, неразветвленными и насыщенными алкильными цепочками главным образом связаны с влагоудерживающей функцией. Ацилцерамиды с линолевой кислотой и церамиды с длинными алкильными цепочками ответственны за защитную функцию. Таким образом, гидрофильные и защитные свойства РС могут быть независимы [4].
Именно это объясняет преобладающую локализацию ботриомиком (рис. 5), контагиозного моллюска (рис. 6) и бородавок (рис. 7) в часто травмируемых местах. Еще один механизм защиты кожи от повторных механических раздражений обеспечивается высокой интенсивностью митотической активности базального слоя и уплотнением эпидермиса [6]. Например, вследствие повторяемого сдавливания и трения РС ладоней и стоп намного толще (приблизительно 500 мкм), чем в других анатомических зонах.
 |
 |
 |
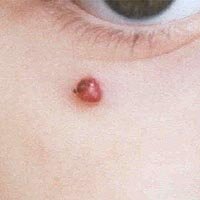
| Быстрорастущая пиогенная гранулема периорбитальной области. |
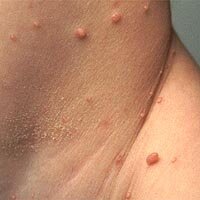
Множественные элементы контагиозного моллюска в подмышечной впадине. |
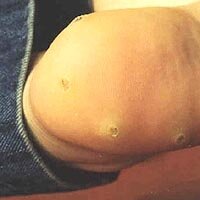
Множественные плоские бородавки, располагающиеся подковообразно в пяточной области. Появились после травмирования неудобной обувью. |
Защита против ультрафиолетового излучения
Защита против актинического повреждения — одна из важных эволюционно обусловленных функций кожи.
Солнечное излучение, достигающее поверхности тела ежедневно, содержит инфракрасный, видимый и ультрафиолетовый (УФ) спектры. УФ зона спектра B (290-320 нм) способна повреждать молекулы ДНК [7], тогда как УФ спектр A (320-400 нм) обеспечивает загар, эритемное действие и старение кожи. Большая часть УФ излучения с длиной волны меньше 320 нм поглощается эпидермисом, стимулирует пролиферацию меланоцитов и не достигает базального слоя. Излучение с длиной волны более 320 нм проникает в сетчатый слой дермы и подкожножировую клетчатку.
Кожа имеет два главных барьера для УФ излучения: кератин, главным образом содержащийся в РС, и меланин, сконцентрированный в меланоцитах. Физиологические реакции кожи на солнечное излучение проявляются утолщением РС и увеличением содержания меланина в эпидермисе [7]. При витилиго или альбинизме, когда содержание меланина в эпидермисе недостаточно, защитная реакция против УФ излучения ослаблена и в большей мере зависит от толщины РС. Фотозащитными
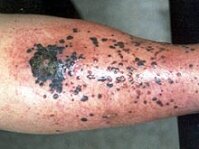
свойствами обладают также роканиновая кислота, производимая кератиноцитами, нуклеиновые кислоты, липиды, липопротеины и каротеноиды [8]. Эти вещества абсорбируют, рассеивают и отражают излучения, предохраняют ДНК, клеточные белки и мембранные липиды от УФ повреждения. Комплексное повреждающее действие УФ излучения на ДНК клеток, угнетение иммунных реакций может приводить к формированию группы заболеваний — актинических (солнечных) кератозов, солнечного эластоза, базально- и плоскоклеточного рака (рис. 8), меланомы (рис. 9).
 |
 |
 |
||
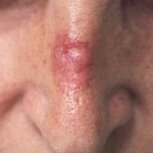
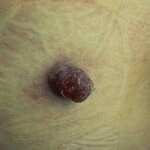
| Поверхностно распространяющаяся базально-клеточная карцинома кожи спинки носа, спровоцированная постоянными солнечными ожогами. | Пиогенная гранулема беременных, возникла на третьем месяце беременности в левой поясничной области. | Первичный очаг меланомы кожи передней поверхности голени с участком изъязвления в центре. Множественные сателлиты и очаги перифокального воспаления. |
Кожный барьер при патологических процессах
Заболевания кожи снижают защитные свойства кожного барьера: они могут изменять степень гидратации, содержание белка или липидный состав РС, приводить к повреждению РС из-за нарушений в пролиферации кератиноцитов [5].
В эпидермальном барьере пациентов с атопическим дерматитом существует первичный дефект, который вызван замедленным синтезом липидов, особенно церамидов [9,10]. Это приводит к появлению дефектов в плазматических мембранах клеток [11,12]. В результате может возникнуть десятикратное снижение защитной функции, создающее условия легкого проникновения в организм возбудителей инфекции и их токсинов [11]. Аллергический контактный дерматит также снижает барьерные свойства РС, увеличивает восприимчивость к физическим раздражителям и сенсибилизирующим агентам [13].
Существует мнение, что умеренное раздражение РС повышает интенсивность эпидермальной пролиферации. Вместе с тем, при повреждениях защитной функции РС воздействием органических растворителей эпидермальный синтез ДНК увеличивается. Это может быть проявлением гомеостатической реакции [14,15]. Защитная функция кожи снижается также при ихтиозе и псориазе. При этом возникает гиперпролиферация кератиноцитов, эпидермальная гиперплазия и последующие воспалительные реакции [14,16]. Трансэпидермальная потеря влаги (ТЭПВ) увеличена при различных формах ихтиоза, группе заболеваний, характеризующихся гиперкератозом, который может быть вызван или эпидермальной гиперпролиферацией, или замедленной потерей корнеоцитов [14,17,18]. Гипотеза о том, что альтерация РС может регулировать эпидермальную пролиферацию, очевидна при ихтиозе "Арлекина", когда отсутствуют ламеллярные тела. Пребывание пациентов в сухой окружающей среде увеличивает ТЭПВ.
Усиление пролиферации кератиноцитов возникает также при псориазе [19], что подтверждается дефектным дифференцированием клеток и измененной проницаемостью кожи [20,21].
Активный псориаз характеризуется высоким уровнем ТЭПВ (до 20-кратного возрастания), увеличенным количеством эпидермальных ламеллярных тел. Таким образом, клинические симптомы и признаки псориаза могут быть связаны с изменениями защитной функции кожи как одного из механизмов поддержания гомеостазиса. Экспериментально показано, что время митотического цикла эпидермиса при псориазе сокращено до 3-4 дней. В результате этого возникает паракератоз, что приводит к ухудшению проницаемости, потому что содержание воды в живых паракератотических клетках увеличено и кожный барьер менее компактен по сравнению с мертвыми корнеоцитами, которые составляют
РС. В некоторых случаях сугубо индивидуальные факторы, свойственные пациенту (возраст, анатомическое расположение, гидратация РС, повреждение РС) могут способствовать проникновению чужеродных агентов сквозь кожу. В периоде беременности ослабление защитных свойств кожи приводит к появлению новых и прогрессированию некоторых заболеваний кожи, в том числе пиогенных гранулем беременных (рис. 10).
Эпидермис — основной аванпост иммунной системы. За инициацию и осуществление иммунных реакций в коже отвечают клетки Лангеранса, кератиноциты и Т-лимфоциты (табл. 1).
Таблица 1. Клетки в эпидермисе, которые участвуют в иммунных реакциях: иммунокомпетентные клетки в эпидермисе (% всех клеток в не-фолликулярном эпидермисе).

Через мощные антитело-продуцирующие клетки, клетки Лангеранса, цитокин-выделяющие кератиноциты и переходящие лимфоциты эпидермис обеспечивает афферентную фазу иммунной реакции, инициируя последующие ее этапы. В зависимости от преобладания типа T-активированных клеток в межклеточную среду выделяется группа цитокинов, которые определяют, является ли иммунная реакция первично гуморальной или клеточной (прямой результат действий T-клеток). Важное свойство кожи — обеспечивать защитный барьер между индивидуумом и окружающей средой. Кожный барьер ограничивает потерю воды, минимизирует поступление токсических соединений, противостоит механической травме. Способность кожи создавать барьер для предохранения организма от агрессивных микроорганизмов и токсинов зависит от возраста, иммунологического статуса и уровня здоровья индивидуума. Здоровая кожа — залог доброго здоровья человека.
Литература
1. Blank I. Cutaneous barriers. J Invest Dermatol 1965; 45: 249-56
2. Dikstein S., Zlotogorski A. Measurement of skin pH. Acta Derm Venereol 1994; 185 (Suppl.): 18-20
3. Miller S., Aly R., Shinefeld H., Elias P. In vitro and in vivo antistaphylococcal activity of human stratum corneum lipids. Arch Dermatol 1988; 124:209-15
4. Imokawa G., Kuno H., Kawai M. Stratum corneum lipids serve as a bound-water modulator. J Invest Dermatol 1991; 96:845-51
5. Williams M., Elias P. From basket weave to barrier: unifying concepts for the pathogenesis of disorders of cornification. Arch Dermatol 1993; 129:626-8
6. MacKenzie I. The effects of frictional stimulation on mouse ear epidermis. I: cell proliferation. J Invest Dermatol 1974; 62:80-5
7. Stierner U. Melanocytes, moles and melanoma. A study on UV effects. Acta Derm Venereol 1991; 168(Suppl.):l-31
8. Baden H., Pathak M. The metabolism and function of urocanic acid in skin. J Invest Dermatol 1967; 48:11-17
9. Werner Y., Lindberg M. Transepidermal water loss in dry and clinically normal skin in patients with atopic dermatitis. Acta Derm Venereol 1985; 65:102-5
10. Imokawa G., Abe A., Jin K., Higaki Y., Kawashima M., Hidano A. Decreased levels of ceramides in stratum corneum of atopic dermatitis: an etiologic factor in atopic dry skin? J Invest Dermatol 1991; 96:523-6
11. Schafer L., Kragballe K. Abnormalities in epidermal lipid metabolism in patients with atopic dermatitis. J Invest Dermatol 1991; 96:10-15
12. Ogawa H., Yoshiike T. Atopic dermatitis: studies of skin permeability and effectiveness of topical PUVA treatment. Pediatr Dermatol 1992; 9:383-5
13. Brasch J, Burgard J, Sterry W. Common pathogenic pathways in allergic and irritant contact dermatitis. J Invest Dermatol 1992; 98:166-70
14. Williams M. Ichthyosis: mechanisms of disease. Pediatr Dermatol 1992; 9:365-8
15. Proksch E., Feingold K., Mao-Quiang M., Elias P. Barrier function regulates epidermal DNA-synthesis. J Clin Invest 1991; 87:1668-73
16. Ghadially R., Reed J., Elias P. Stratum corneum structure and function correlates with phenotype in psoriasis. J Invest Dermatol 1996; 107:558-64
17. Frost P., Weinstein G., Bothwell J., Wildnauner R. Ichthyosiform dermatoses. III. Studies of transepidermal water loss. Arch Dermatol 1968; 98:230-3
18. Lavrijsen A., Oestmann E., Hermans E., Bodde H., Vermeer B., Ponec M. Barrier function parameters in various keratinization disorders: transepidermal water loss and vascular response to hexyl nicotinate. Br J Dermatol 1993; 129:547-54
19. Dover R., Watt F. Measurements of the rate of epidermal terminal differentiation: expression of involucrin by S-phase keratinocytes in culture and in psoriatic plaques. J Invest Dermatol 1987; 89:349-352
20. Blichmann C., Serup J. Reproducibility and variability of transdermal water loss measurements. Acta Derm Venereol 1989; 67:206-10
21. Bernard F., Magnaldo T., Darmon M. Delayed onset of epidermal differentiation in psoriasis. J Invest Dermatol 1992; 98:902-10.